

: 実験操作
: 実験
: 蛍光分光光度計(RF-1500)の使い方
脂質は、低濃度で用いることが多く、固体試料を微量計量することがむずかしい
ので、適当な濃度のクロロホルム溶液を作製しておき、それから決まった体積を
測り取ることで量を調整する。この適当な濃度に調整した脂質のクロロホルム溶
液を、脂質の保存溶液(stock solution)と呼ぶ。脂質の保存溶液は、脂質の分解
を防ぐため、-20℃以下で保存する。試薬業者から購入したクロロホルム溶液は、
50mg/ml とか 1mg/ml のような濃度になっているので、そのままでは使用し難い。
脂質の分子量を考慮して、10mM や 100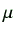 M のような濃度の保存溶液に薄め
てから使用する。
M のような濃度の保存溶液に薄め
てから使用する。
脂質は一般に高価であるので、グループ毎に新規に保存溶液を作成することはせ
ずに、保存溶液は共用する。以前に作成された保存溶液が残っていれば、それを
利用する。したがって、保存溶液の作成は重要で、間違った濃度で作成した場合
には、それ以後のすべての実験に影響を及ぼすので、慎重に行うこと。ここでは、
購入した脂質のクロロホルム溶液(ガラスアンビル瓶) をクロロホルムで希釈し
て、保存溶液を作成する方法を述べる。
- 購入した脂質のクロロホルム溶液は、生物物理研究室(理学部総合棟5階)
の -80℃の冷凍庫に保存されているので、実験室の原液が
なくなったら、担当教員または TA に申し出る。
- 購入した脂質のクロロホルム溶液は、ガラスの密封容器(アンビル瓶)で供
給される場合が多い。アンビル瓶には、首のところに切口が付いているの
で、内容物がこぼれないように注意して切口より上を曲げると、切口部分
で割れて、口が開く。口が開いたアンビル瓶は、そのままでは、溶媒が蒸
発してしまうので、速やかに、キャップの付いたバイアル瓶に移す。移す
場合には、パスツールピペットを用いる。以前の原液が入っていたバイア
ル瓶に残料があれば、それに追加してもよい。その場合には、前回と今回
の原液の濃度が同じであることを、必ず確認する。前回の残料がほとんど
ない場合は、新しいバイアル瓶に移す。バイアル瓶は、4mlの容量だが、
満杯にすると、ピペットを挿入した時に溢れるので、原液の量が多い場合
には、複数のバイアル瓶に移す。原液のバイアル瓶は、種類や濃度がはっ
きりとわかるようにしておく。
- 原液のクロロホルム溶液の濃度から、DOPC の場合は 10mM、Rh-DOPE と
NBD-DOPE の場合は 100
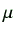 M の濃度になるような溶媒と原液の量を計
算する。クロロホルムは、プラスチック製のピペットマンチップをわずか
に侵蝕するので、ガラス製のピペットやシリンジを用いて、目的の濃度の
保存溶液を作成する。保存溶液を冷凍庫に保存する場合は、溶媒が蒸発し
て濃度が変わることのないように、ふたを強く閉めて、更に、パラフィル
ムでふたを固定しておく。
M の濃度になるような溶媒と原液の量を計
算する。クロロホルムは、プラスチック製のピペットマンチップをわずか
に侵蝕するので、ガラス製のピペットやシリンジを用いて、目的の濃度の
保存溶液を作成する。保存溶液を冷凍庫に保存する場合は、溶媒が蒸発し
て濃度が変わることのないように、ふたを強く閉めて、更に、パラフィル
ムでふたを固定しておく。
- 作りたい脂質の濃度と体積を決め、脂質の保存溶液の必要量を計算し、適当な大き
さ(今回の実験では、すべて4mlの容量)のバイアル瓶を準備する。
- 脂質のクロロフォルム溶液をピペットまたはマイクロシリンジで測り、バイア
ルに移す。100
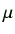 l以下であれば、マイクロシリンジを使う。マイクロシリンジ
は、まず、洗浄用のクロロホルムで何回か洗い(吸い込んでから外に捨てる)、
測りたいクロロホルム溶液で1〜2回洗って(共洗い)から用いる。使用した後
は、洗浄用クロロホルムで洗っておく。
l以下であれば、マイクロシリンジを使う。マイクロシリンジ
は、まず、洗浄用のクロロホルムで何回か洗い(吸い込んでから外に捨てる)、
測りたいクロロホルム溶液で1〜2回洗って(共洗い)から用いる。使用した後
は、洗浄用クロロホルムで洗っておく。
- 窒素ガス吹き付け装置でクロロホルムを飛ばす。窒素ガス吹き付け装置は、ま
ず、飛ばしたいバイアルの個数だけの吹き付け口を準備し、他の口はピンチコッ
クで塞ぎ、窒素ボンベの元と減圧弁の出口バルブを開ける。次に、吹き付け口
(パスツールピペット)から1cmくらいのところに手をかざして風量を確認し
ながら、減圧弁を徐々に開ける。手で、風を感じる程度の流量で十分である。
次に、液面が吹き出し口から5mm程度離れる距離にバイアルをクランプで固定
する。数分でクロロホルムは蒸発する。
- 残留クロロホルムを完全に蒸発させるため、真空デシケーター中に1時間以上
放置する。まず、窒素ガス吹き付け装置でクロロホルムを蒸発させたバイアル
瓶をガラスデシケーター中に入れ(バイアル瓶のキャップは外したままか、緩く
被せるかのどちらかにする)、デシケーターのふたを閉
める。ロータリーポンプにつながった真空ゴムホースをデシケーターの吸い込
み口につけて、吸い込み口のコックを閉めてから、ロータリーポンプのスイッ
チをONにして、まず、吸い込み口までを真空に引く。ロータリーポンプの音が
落ちついて吸い込み口までが真空になったら、吸い込み口のコックを少し開け
る。ロータリーポンプの油蒸気が激しく出たら、コックを少し閉めて、少しず
つ引くようにする。コックを開けてもロータリーポンプの音があまり変わらな
いようになったら、コックを全開にする。1時間以上引いたら、デシケーター
の吸い込み口のコックを閉めて、ロータリーポンプのスイッチをOFFにする。
真空ゴムホースをはずし、吸い込み口のコックを徐々に開けて大気圧に戻して
から、デシケーターのふたをずらして開けてバイアルを取り出す。このとき、
バイアルの壁面に脂質がフィルム状に付着しているのを確認する(濃度の薄く色
素を含まない場合は、肉眼でははっきりとはわからないかもしれない)。
この状態で、冷凍庫に入れておけば、数週間は脂質は安定である。
- バイアルに蒸留水をピペットマンで加え、バイアルのふたをきつく締める。一旦
水を入れると、脂質は非常に分解しやすくなるので、水を入れた脂質水溶液
(リポソーム溶液)は、出来るだけ早く測定する(少なくとも、1週間以上は放置
しない)。また、水を入れたバイアル容器を冷凍庫に入れると、氷の生成によっ
て膨張し、バイアル瓶が壊れるので、水を入れた後の試料を保存する場合
は、冷蔵庫に入れる。
- 超音波発生器の準備をする。一般に、超音波によってリポソームを作製する場
合、温度は膜が液晶相である温度(主相転移よりも10℃程度以上高温)で行う必要
がある。したがって、DOPCのリポソームのみを作成する場合は室温の水でもよい
が、DPPCを含むリポソームを作成する場合(実験4)は
55℃程度の湯を超音波水槽に入れてHEATERをONにする。
超音波発生器付属のヒーターは出
力が弱く、水から温度を上げるには長時間かかるので、湯沸機から湯を入れる。
- バイアル内の液面が、超音波水槽の液面よりも低くなるように、バイアルを手
で持ち、超音波の出力を最大にして、30秒程度超音波をかける。
取り出してすぐに試験管ミキサーで激しく撹拌する。この操作を3〜4回繰り返
す。これで、脂質のフィルムが壁面からはがれ、リポソームが生成される。水
溶液が白く懸濁するはずである。この段階のリポソームは、ほとんどが多重層
膜(MLV)になっている。リポソームの膜融合を観察する以外のリポソームは、
MLVでよいので、これで操作終了。
- 膜融合の測定に用いるリポソームはSUVであるので、(7)で調製したMLVに高出
力の超音波をかけてSUVを作製する。高出力の超音波は、生物物理研究室の
総合棟 533号室に設置されているプローブ型の超音波発生器を用いて、3〜4分超音波を
かける。超音波により最初白く濁っていた懸濁液が透明になっていくことを確
認する。実際にこの超音波装置を使う場合は、教官やTAなどに相談する。
ガラス器具は破損し易いので取り扱いには十分に注意を払い、再使用のために
よく洗浄しなければならない。洗浄は使用後、速やかに行うのがよい。水溶性
のものであれば、水道水で洗い蒸留水すすげば十分である。脂溶性(有機溶媒
に可溶)であればエタノールで洗い流し蒸留水ですすげばよい。そのために、
蒸留水の入った洗浄ビンおよびエタノールの入った洗浄ビンが用意してある。
勿論、洗剤を用いてスポンジまたはブラシを使えば汚れをほぼ完全に取り除く
ことが出来る。洗い難い構造のものは超音波洗浄機が効果的である。いずれに
しても、使用した者が汚れについてもっともよく知っているのだから、責任を
持って洗うことである。洗浄したガラス器具は乾燥機で乾燥する。乾燥機の温
度は60℃で用いる。メスピペットなどの量を計るガラス器具は高温では変形す
る可能性があるので、自然に風乾させるのが原則である。しかし、メスピペッ
トは風乾ではなかなか乾燥しないので、60℃という低温の乾燥機で乾燥させる。
加熱により溶けるプラスチック類(バイアル瓶のふたやピペットマンのチップ)
は風乾させる。乾燥した器具は速やかに所定の場所に移して格納する。